NOG小鼠作为一款超重度免疫缺陷鼠,能够实现人源肿瘤细胞系或者肿瘤组织的移植,也能减少对治疗T细胞的排斥,故在临床前能够对TIL/ACT/CAR-T等细胞治疗进行一定的药效评估,但是最新研究表明,利用NOG的新一代模型hIL-2 NOG小鼠更能准确预测这些T细胞疗法的效果。
hIL-2 NOG小鼠:在NOG基础上转入人的细胞因子IL-2, 可以持续稳定表达人的细胞因子IL-2
最新研究结果表明:
1.hIL-2 NOG小鼠模型已在ACT/TIL治疗中展现了非常准确的临床预测作用[1,2,3,4]。
2.hIL-2 NOG小鼠模型将在CAR-T/TCR-T治疗实体瘤中提供重要的数据支撑,加快药物的研发进程[5,6,7]。
目前的研究结果表明:hIL-2 NOG小鼠更适合用于PDXv2的建模,以精准的预测ACT/TIL治疗的临床效果[1,2,3,4]
首先我们了解一下什么是PDXv2模型?
PDXv2模型是指将病人来源的肿瘤组织移植到超重度免疫缺陷鼠NOG/hIL-2 NOG小鼠上,然后再进一步移植同一个病人来源的TIL(tumor-infiltrating T lymphocytes)细胞进行治疗,以进一步判定TIL/ACT的抗肿瘤杀伤活性及对后续的临床用药给予指导的研究用模型。
Henrik Jespersen研究发现:临床上有效的TIL/ACT疗法,体外扩增培养的TIL/ACT与肿瘤组织共培养也有肿瘤杀伤活性,但在NOG/NSG小鼠体内没有抗肿瘤活性, 无法在临床前预测ACT/TIL的抗肿瘤活性[1]。
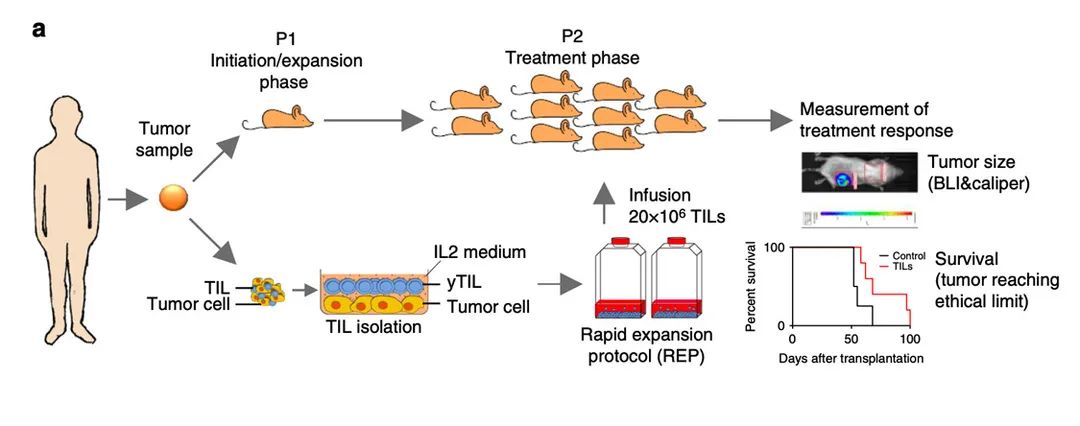
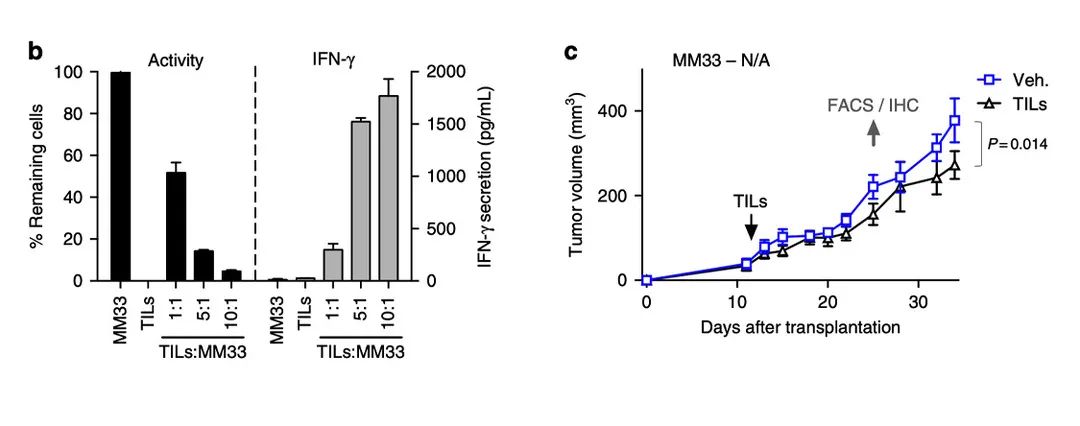

哥德堡大学癌症研发中心的Henrik Jespersen教授非常清楚细胞因子IL-2对T细胞的增殖扩增非常重要,故提出一个设想:
设想一:
通过对NOG小鼠额外补充人源细胞因子IL-2进行药效验证:
(NOG+hIL-2+PDX+TIL)
但实验结果显示TIL的抗肿瘤活性没有增强。
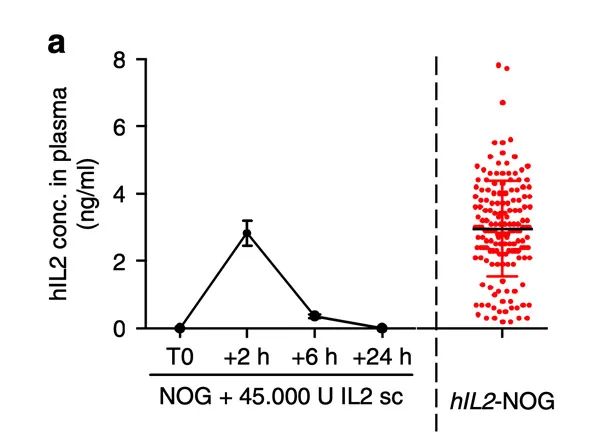
主要原因是由于使用的临床级IL-2半衰期过短,或者注射剂量过低。在给NOG小鼠模型注射hIL-2后2小时,表达量达到峰值,8小时后消失。
而hIL-2 NOG小鼠中,hIL-2的持续表达水平能与NOG小鼠注射hIL-2后的峰值保持一致。
基于以上原因,Henrik Jespersen教授提出另一个设想:
设想二:
直接利用hIL-2 NOG小鼠进行TIL/ACT的临床前抗肿瘤药效验证
(hIL-2 NOG+PDX+TIL)
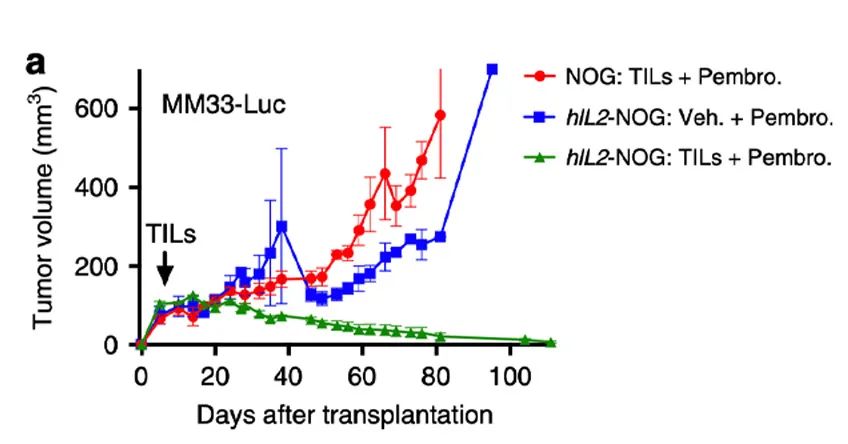
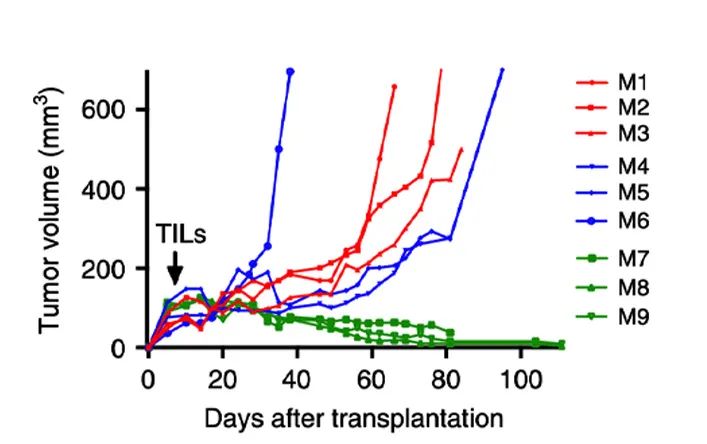
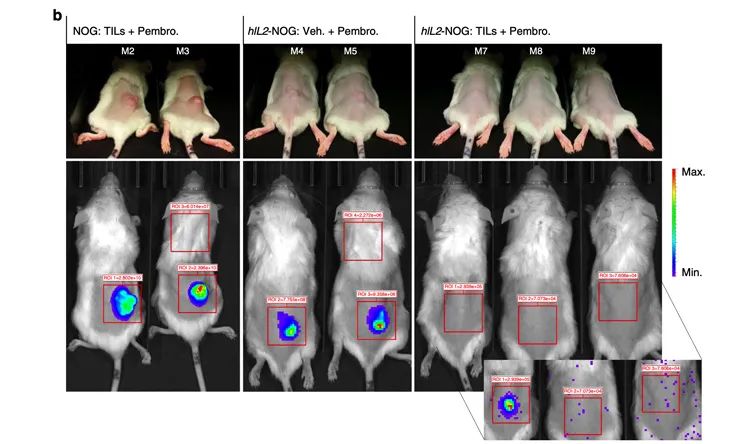
结果显示TIL/ACT在hIL-2NOG小鼠体现出了明显的抗肿瘤活性,与临床上的数据一致[1]。
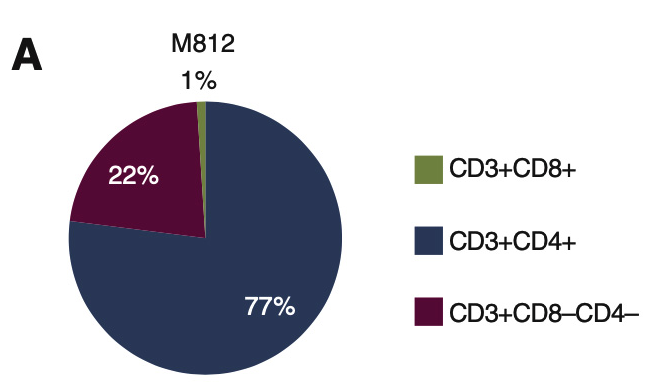
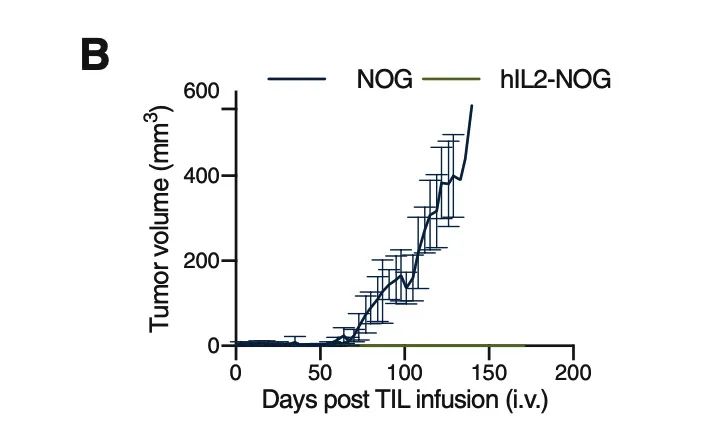
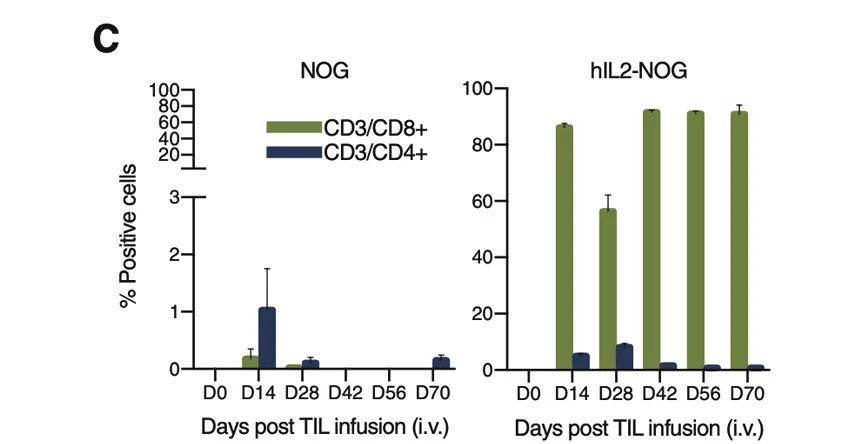
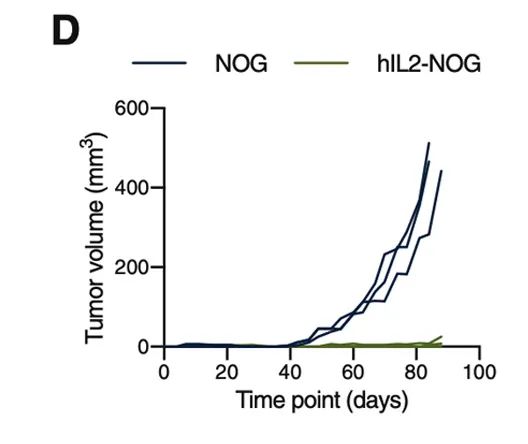
PDXv2模型中显示TILs完全抑制了hIL2-NOG小鼠的肿瘤生长,但在NOG小鼠中却没有作用,与临床结果一致。证明hIL2-NOG小鼠可用于评估黑色素瘤TIL的抗肿瘤免疫活性。
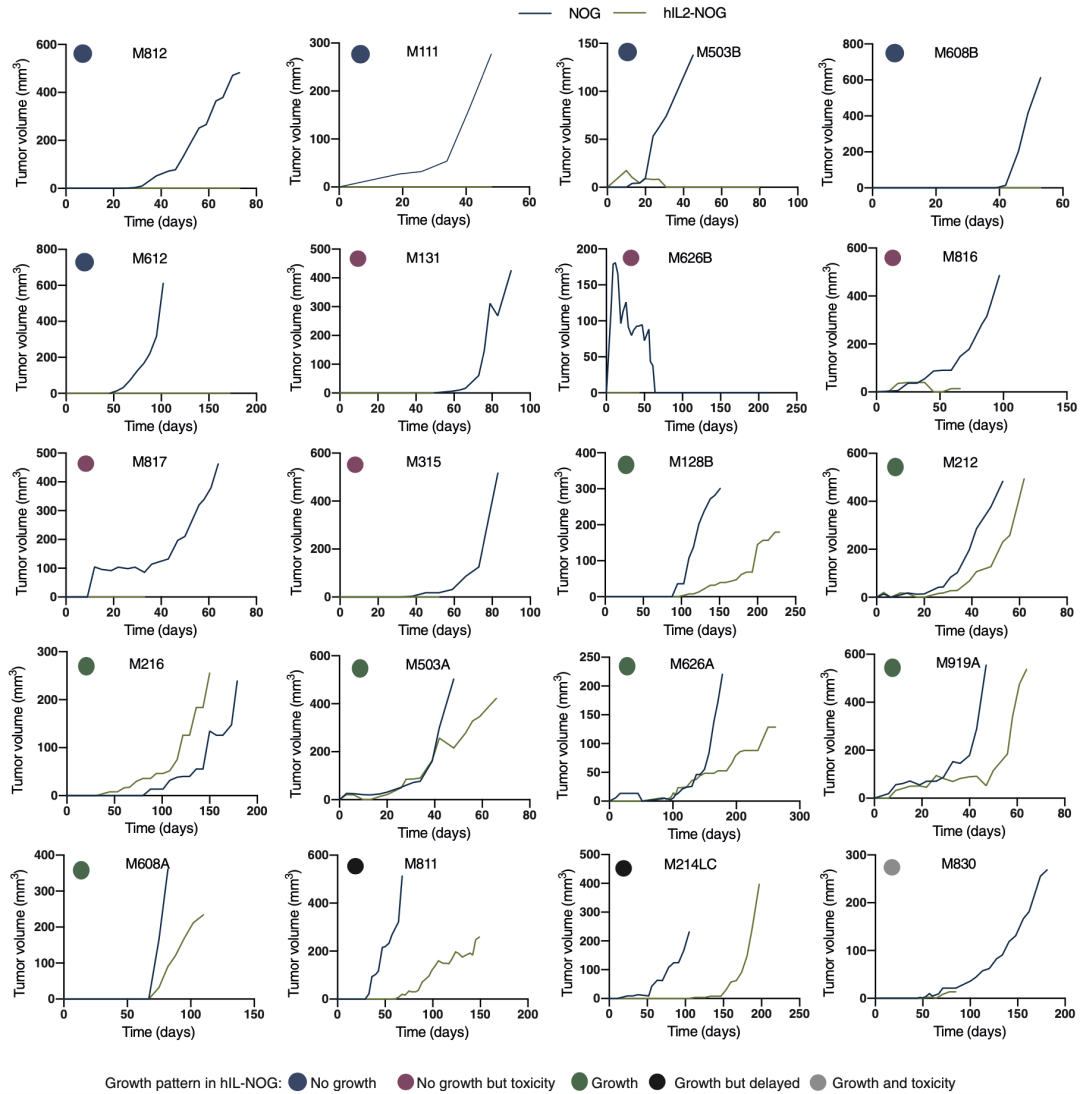
利用hIL-2 NOG模型,不同患者来源的TILs出现不同的抗肿瘤活性;利用NOG小鼠,不同患者来源的TILs均不能有效地发挥抗肿瘤活性。
证明hIL-2 NOG小鼠可以有效地预测临床患者TILs的抗肿瘤活性,以进一步指导临床用药[4]。
越来越多的案例,支持hIL-2 NOG可以很好的预测肿瘤患者的TIL活性,以指导进一步的临床用药[3,4]。
利用hIL-2 NOG小鼠可以证明HER2 CAR-T细胞治疗对葡萄膜黑色素瘤的杀伤活性,助力于临床转化:这些葡萄膜黑色素瘤患者对免疫检查点抑制剂和TILs无反应[5]。
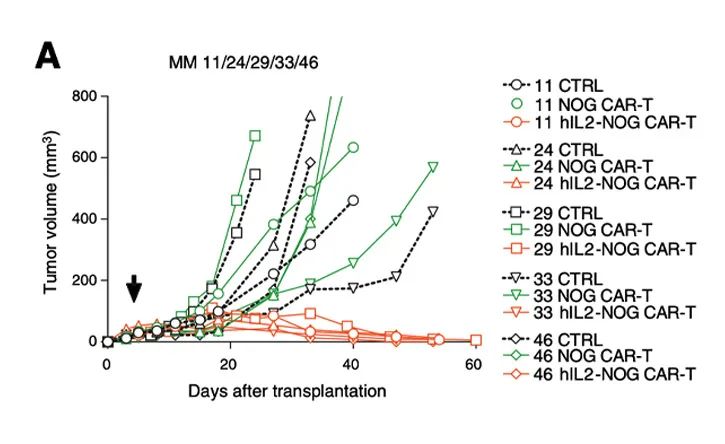
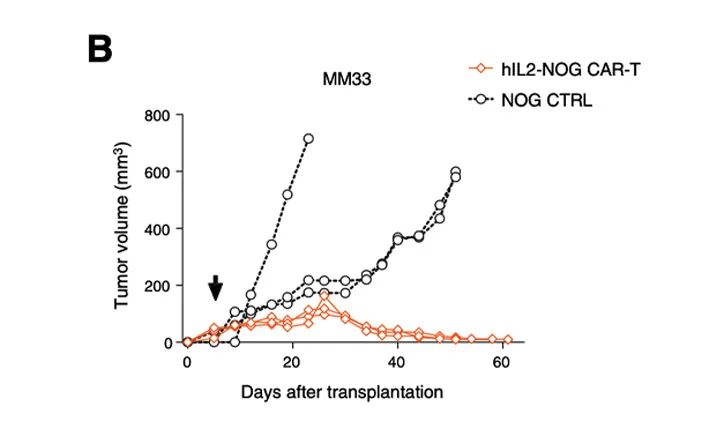
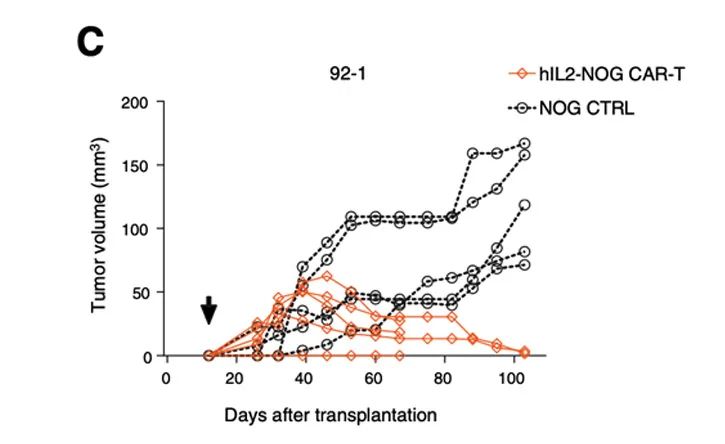
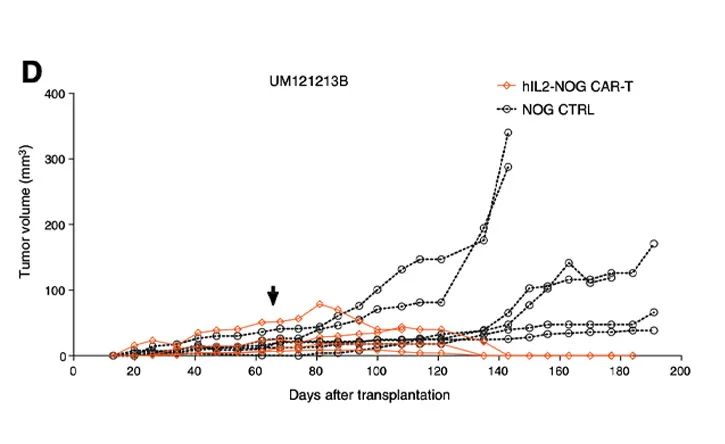
在体外,HER2 CAR-T细胞对表达HER2的黑色素肿瘤细胞有一定的杀伤作用;
在体内,HER2 CAR-T细胞在hIL-2 NOG小鼠模型中对黑色素瘤的杀伤作用,但在NOG小鼠体内无法模拟抗肿瘤活性。
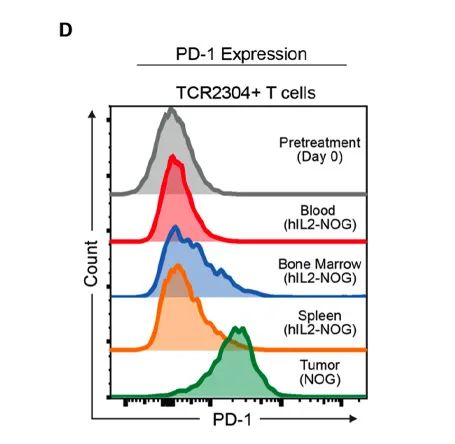
Arnaud, M.等的研究发现:识别肿瘤抗原特异性的TCR-T细胞治疗,可以利用hIL-2 NOG小鼠进行很好的体内药效测试[7]。
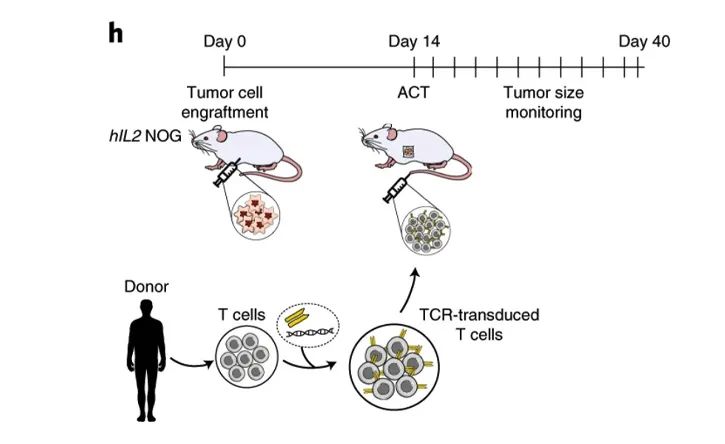
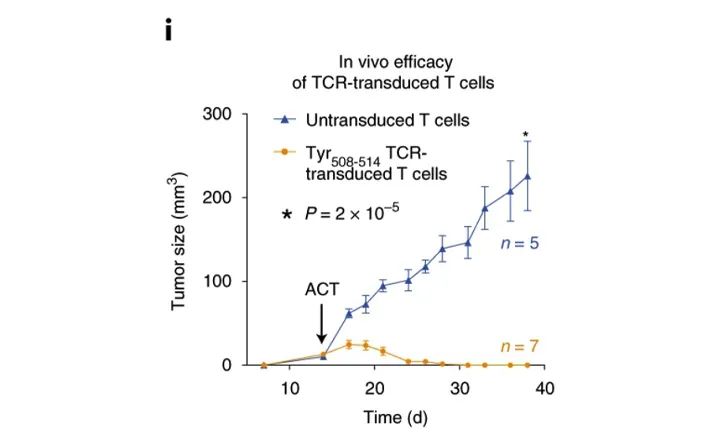
Arnaud, M.等利用NeoScreen鉴定的抗原特异性TCRs在体外和体内具有抗肿瘤反应性。上图展示了在体内用hIL-2 NOG小鼠的体内研发数据。这支持了在TCR基因转移治疗中使用NeoScreen进行特异性抗原鉴定的可行性。
Çınar Ö等的研究发现:针对B细胞淋巴瘤MyD88 L265P突变的TCR-T细胞治疗,可以利用NOG和hIL-2 NOG小鼠进行体内药效测试, 均有较好的肿瘤抑制效果[6]。但NOG小鼠在给药后40天左右肿瘤出现复发,而hIL-2 NOG小鼠表现出持续的抗肿瘤作用。
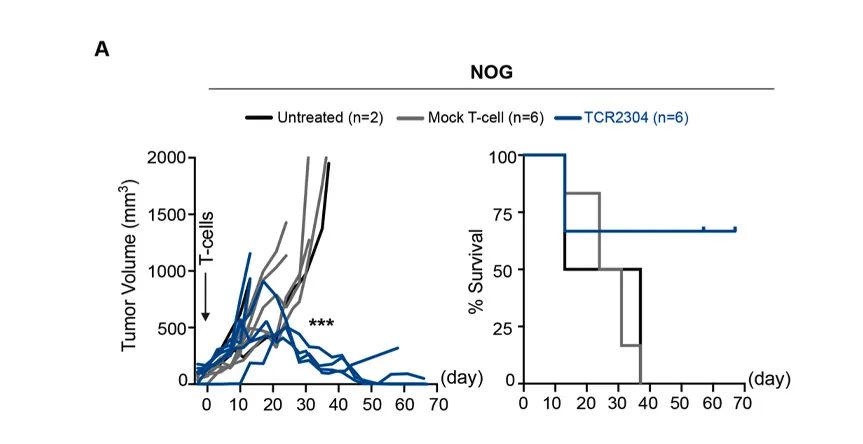
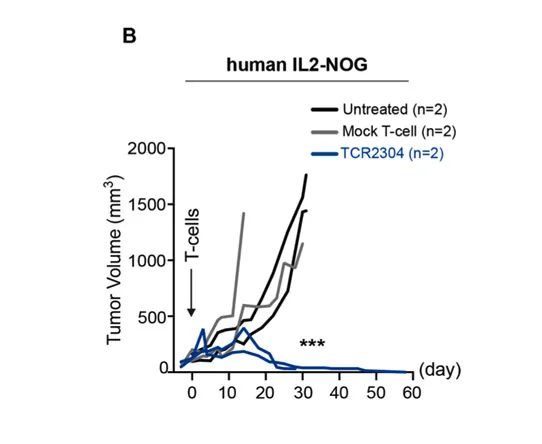
为了评价在初始反应后导致肿瘤再生的机制,在第58天处死在第40天开始出现肿瘤再生的NOG小鼠,同时处死在hIL2-NOG TCR-T治疗组中的小鼠。我们观察到,hIL2-NOG小鼠的血液、骨髓和脾脏中仍然有大量的人类T细胞,而NOG小鼠的肿瘤中只剩下一些T细胞。进一步说明hIL-2 NOG小鼠是一个更适合的体内TCR-T细胞治疗的评价模型。
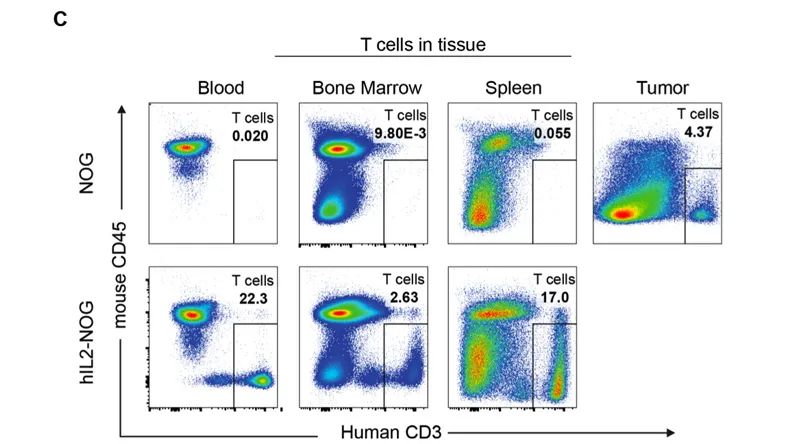
虽然CAR-T疗法已在血液瘤中取得重大突破,但在有更多患者的实体瘤中却无法攻克。这些研究结果已显示hIL2-NOG小鼠可作为一个非常合适的小鼠模型,以测试新型CAR-T细胞对实体瘤的杀伤作用。
另外,IL-2依赖性也可能意味着,CAR-T细胞迄今为止对实体肿瘤的临床疗效有限的原因之一是,肿瘤微环境中IL-2信号通路的减少导致免疫细胞耗竭和抑制[8]。此研究结果表明后续对于实体瘤的CAR-T疗法更倾向尝试IL-2信号通路充足且没有免疫细胞耗竭的CAR-T细胞[9,10]。
维通利华深知hIL-2 NOG小鼠中IL-2细胞因子表达量及其稳定对研究者的重要性,故对每只繁育用的种鼠进行检测验证,只有检测合格的动物才能作为种鼠;同时对发给客户的动物进行验证,确保细胞因子表达完全符合要求。
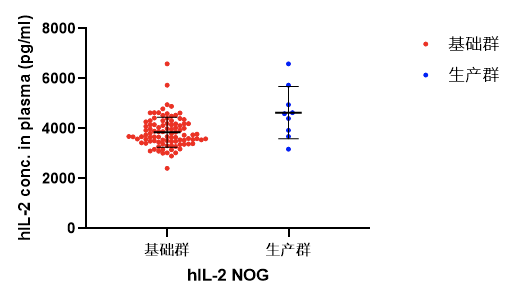 维通利华繁育的hIL-2 NOG小鼠,相较文献报道而言,血浆中hIL-2的表达量更加均一稳定。
维通利华繁育的hIL-2 NOG小鼠,相较文献报道而言,血浆中hIL-2的表达量更加均一稳定。
有研发者使用hIL-2 NOG 进行研究时,发现会出现一定的GvHD反应,出现GvHD反应的严重程度与下列多种因素相关:
1. Donor来源
2. 不同的细胞体外处理
3. 剂量的高低
......
研究发现,如果TIL事先在含有IL-2细胞因子的前提下体外培养,会产生更多的CD8+ T细胞,故导致GvHD反应的其他细胞就会大幅减少,从而GvHD反应会减弱[11]。
1.Jespersen H, Lindberg MF, Donia M, et al. Clinical responses to adoptive T-cell transfer can be modeled in an autologous immune-humanized mouse model. Nat Commun. 2017;8(1):707. Published 2017 Sep 27. doi:10.1038/s41467-017-00786-z
2.Einarsdottir, B.O., Karlsson, J., Söderberg, E.M. et al. A patient-derived xenograft pre-clinical trial reveals treatment responses and a resistance mechanism to karonudib in metastatic melanoma. Cell Death Dis 9, 810 (2018).doi.org/10.1038/s41419-018-0865-6
3.T. Helleday. Using personalized immune-humanized xenograft mouse models to predict immune checkpoint responses in malignant melanoma: potential and hurdles. EDITORIAL|VOLUME 31, ISSUE 2, P167-168. FEBRUARY01,2020 doi.org/10.1016/j.annonc.2019.11.007
4. L. Ny; L. Y. Rizzo; V. Belgrano; J. et al. Supporting clinical decision making in advanced melanoma by preclinical testing in personalized immune-humanized xenograft mouse models. Annals of Oncology, ISSN: 0923-7534, Vol: 31, Issue: 2, Page: 266-273
5. Elin M.V. Forsberg, Mattias F. Lindberg. et al. HER2 CAR-T Cells Eradicate Uveal Melanoma and T-cell Therapy–Resistant Human Melanoma in IL2 Transgenic NOD/SCID IL2 Receptor Knockout Mice. DOI: 10.1158/0008-5472.CAN-18-3158 Published March 2019
6.Çınar Ö, Brzezicha B, Grunert C, et alHigh-affinity T-cell receptor specific for MyD88 L265P mutation for adoptive T-cell therapy of B-cell malignanciesJournal for ImmunoTherapy of Cancer 2021;9:e002410. doi: 10.1136/jitc-2021-002410
7.Arnaud, M., Chiffelle, J., Genolet, R. et al. Sensitive identification of neoantigens and cognate TCRs in human solid tumors. Nat Biotechnol (2021) .doi.org/10.1038/s41587-021-01072-6
8.Carter L, Fouser LA, Jussif J, et al. PD-1:PD-L inhibitory pathway affects both CD4+ and CD8+ T cells and is overcome by IL-2. Eur J Immunol 2002;32:634–43
9.Kagoya Y, Tanaka S, Guo T, et al. A novel chimeric antigen receptor containing a JAK–STAT signaling domain mediates superior antitumor effects. Nat Med 2018;24:352.
10.Ren J, Liu X, Fang C, et al. Multiplex genome editing to generate universal CAR T cells resistant to PD1 inhibition. Clin Cancer Res 2017;23:2255–66
11.Ito R, Katano I, Kawai K, et al. A novel xenogeneic graft-versus-host disease model for investigating the pathological role of human CD4þ or CD8þ T cells using immunodeficient NOG mice. Am J Transplant. 2017;17:1216e1228.




