NOG-EXL小鼠(NOG-hGM-CSF/hIL-3-Tg),通过在NOG小鼠转入编码人IL-3和GM-CSF基因获得,IL-3和GM-CSF是髓系细胞发育分化的重要细胞因子,该模型在髓系细胞参与的多种研究中发挥重要的作用。
NOG-EXL移植huHSC后,除T、B细胞外,还可重建髓系细胞(单核/巨噬细胞、粒细胞、树突状细胞等),是目前重建人类免疫系统较为完整且最能模拟人的免疫细胞组成的模型。是目前肿瘤免疫疗法的推荐模型,一方面可允许多种免疫细胞参与,另一方面更加模拟了临床上的免疫肿瘤微环境。也可用于宿主特异性强的传染病研究(HIV, EBV)。
NOG-EXL移植huHSC后,模拟以髓系细胞(如肥大细胞、嗜碱性粒细等)主要参与介导的过敏、哮喘等炎症反应。
IL-3和GM-CSF能促进髓系来源的肿瘤细胞的生长与增殖,NOG-EXL可提高移植效率并保留肿瘤异质性。
前两方面的应用我们在之前的内容中均有介绍,今天我们来看一下NOG-EXL小鼠在髓系血液瘤研究中的应用及优势。
髓系白血病是指髓系造血干/祖细胞异常增殖的恶性肿瘤,根据病程进展、病因等不同分为急性髓系白血病(Acute Myeloid Leukemia,AML)和慢性髓系白血病(Chronic Myeloid Leukemia,CML)。
在肿瘤研究中,将患者肿瘤组织/细胞移植到小鼠体内,用于探究肿瘤的发病机制和疗法评估等,是常用的研究手段。该方法在实体瘤中重建效果普遍不错,然而大多数的AML和CML造模效果却不尽如人意。推测原因可能有多种,如归巢、残余鼠源免疫功能发挥作用、小鼠体内缺乏特定的人源生长因子和支持细胞、免疫监视逃逸、以及肿瘤样本的生物学特性等等。
如何提升髓系白血病ML异种移植的成功率?并保留肿瘤高度特质性?是设计建立异种移植模型时要考虑的重点。
理想的动物模型,需要提供适宜肿瘤生存、生长的体内环境。使用免疫缺陷程度更高的动物,可以减少残存的鼠源免疫功能,移植率略有升高。但相较于实体瘤水平仍然偏低。且曾有研究称[1]AML细胞移植到重度免疫缺陷小鼠体内,很难出现骨髓细胞正常/异常增生,容易误导对疾病的认识。在降低鼠源免疫干扰的情况下,人源细胞发育仍然受阻,究其原因是缺乏人源化的微环境。
NOG-EXL小鼠,在超重度免疫缺陷小鼠NOG体内转入了编码人IL-3和GM-CSF基因。这两种细胞因子可刺激造血干细胞的增殖,刺激粒细胞、单核细胞等髓系祖细胞的生成、增殖、成熟与部分功能的强化。因此,NOG-EXL小鼠可为髓系白血病移植提供更适宜的生存环境,更有利于肿瘤细胞在体内的增殖,提高移植效率 。尤其是PDX模型,组织来源珍贵,且肿瘤微环境更加复杂,使用NOG-EXL小鼠可以提升样本利用率和成功率。
IL-3:刺激造血干细胞的增殖,刺激粒细胞、单核细胞等髓系细胞祖细胞的生成、增殖与功能加强。
GM-CSF:粒细胞-巨噬细胞集落刺激因子,可兴奋骨髓的造血功能,刺激粒细胞、单核细胞和T细胞的增殖,并促进单核细胞和粒细胞的成熟。
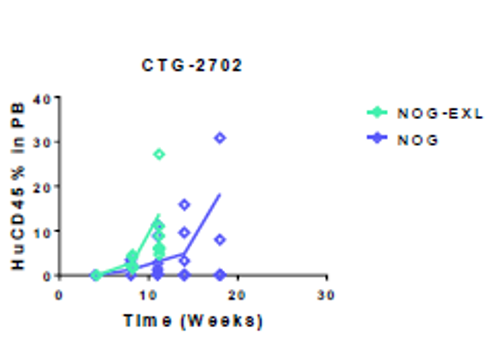
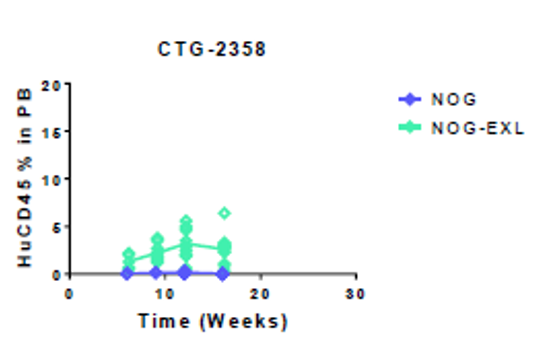
Champions Oncology数据[2]显示:接种同一AML患者来源的肿瘤细胞,与NOG相比,NOG-EXL可以促进移植成功率,加速肿瘤细胞在体内的增殖。
另有文献[3]发现,接种同一AML患者的PBMC细胞(剂量:5*105个/只),相较于NOG,NOG-EXL移植成功率和骨髓嵌合率有明显提升,分别为100% vs. 42%和52% vs. 14%。
NOG-EXL已逐步应用于AML和CML肿瘤模型的建立,并支持进一步的体内药效评价。

用NOG-EXL小鼠建立AML的PDX模型,移植成功率高达62%(16/26)[3]。分别给予两种不同BET抑制剂或与靶向BCL-2的venetoclax(VEN)联用,根据动物脾脏、骨髓、外周血中幼稚细胞数量的被抑制程度,来验证疗法的安全性及有效性。结果显示BET抑制剂单药即可减轻动物肿瘤负荷,与VEN药物联用药效增强。
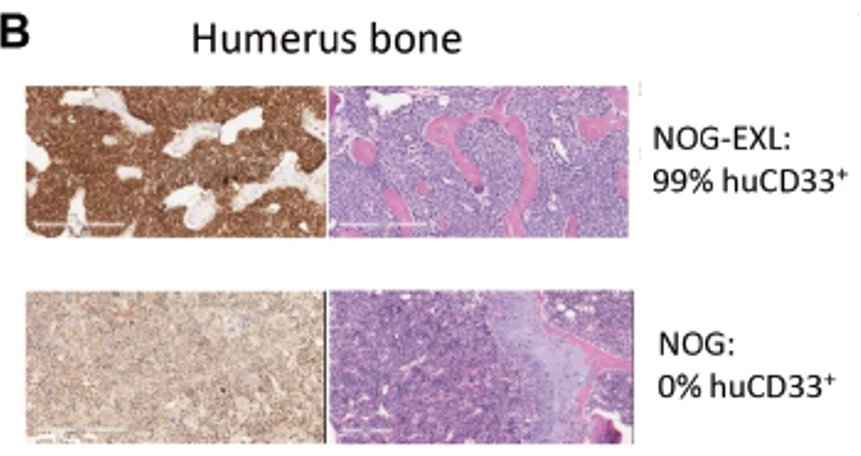
NOG和NOG-EXL移植同一患者来源的AML细胞(CTG-2241),对肱骨切片染色hCD33+AML细胞确认造模是否成功。
结果显示:NOG切片中未发现huCD33+AML细胞,重建失败。NOG-EXL小鼠肱骨内有大量huCD33+细胞,移植成功。
使用NOG-EXL建立AML模型,评估药物疗效
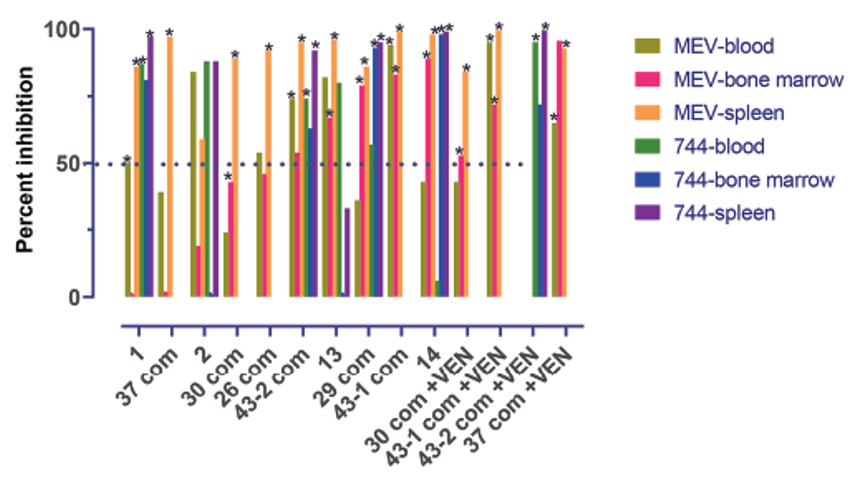
使用NOG-EXL建立AML模型,通过比较脾脏、骨髓、外周血中幼稚细胞数量的被抑制程度评估疗效。
BET抑制剂Mivebresib单药降低动物骨髓中的肿瘤负荷(5/10),另一BET抑制剂ABBV-774也表现明显药效(4/6)。BET抑制剂与VEN联用有药效增强的趋势,尤其是在骨髓和脾脏中(3/5)。

白血病干细胞与慢性髓系白血病(CML)的复发相关,将其清除是CML治疗的主要目标之一。
研究者将CML病人来源的CD34+细胞移植到经辐照处理的NOG-EXL小鼠体内。
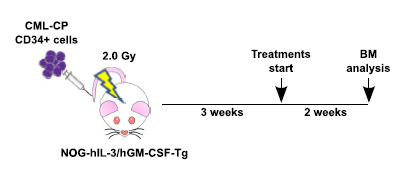
使用NOG-EXL建立CML模型,评估药物疗效
流式检测确认造模成功后,单独或联合给予IRAK1/4抑制剂或(和)抗PD-L1单抗。通过比较白细胞(hCD45+)、造血祖细胞(hCD34+CD38-)和造血干细胞(hCD34+CD38-CD45RA-CD90+)的变化评估治疗效果。
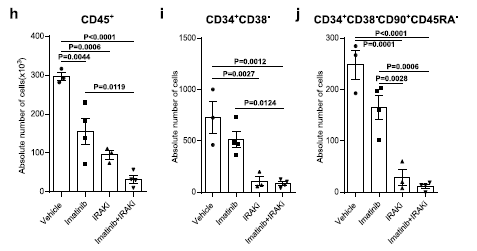
实验发现:联合用药对这三类细胞的清除效率更高,治疗效果更加明显[4]。
NOG-EXL小鼠拥有超重度免疫缺陷背景,其表达的人源细胞因子GM-CSF和IL-3,是人髓系细胞生长和分裂所需的主要细胞因子。为AML和CML肿瘤细胞提供更适宜的生长发育环境,在保留肿瘤异质性的同时还可显著提升移植效率,是异种移植模型的升级版选择。
获取更多信息请联系我们
邮箱:Product@criver.cn
1. Vargaftig, J et al. “Frequency of leukemic initiating cells does not depend on the xenotransplantation model used.” Leukemia vol. 26,4 (2012): 858-60. doi:10.1038/leu.2011.250
2. Wesa, Amy. "Next Generation Humanized Mice for Acute Myeloid Leukemia and Natural Killer Cell Therapy Testing." Champions Oncology 2020. Web.
3. Albert, Daniel H et al. “Co-clinical Modeling of the Activity of the BET Inhibitor Mivebresib (ABBV-075) in AML.” In vivo (Athens, Greece) vol. 36,4 (2022): 1615-1627. doi:10.21873/invivo.12872
4. Tanaka, Yosuke et al. “Eliminating chronic myeloid leukemia stem cells by IRAK1/4 inhibitors.” Nature communications vol. 13,1 271. 12 Jan. 2022, doi:10.1038/s41467-021-27928-8




