SRG大鼠 (Sprague Dawley-Rag2em2heraIl2rgem1hera/HblCrl), 是在SD大鼠背景上,通过敲除Rag2 和IL2rγ基因而获得的近交系大鼠,体内缺失功能性T、B和NK细胞。
Rag2 (重组激活基因2),负责编码T、B细胞受体重排和重组所需要的关键酶,敲除该基因后V(D)J重排受阻,阻断功能性T、B细胞生成,动物体内缺乏成熟的T、B细胞。
Il2rγ(白介素-2受体gamma链)可与IL-2, IL-15等多种细胞因子高亲和力结合,参与介导调节多种免疫细胞的功能。敲除Il2rγ基因后,导致多种信号通路缺失,尤其影响与IL-15结合从而阻断NK细胞发育,造成NK细胞缺失。
SRG大鼠外周血中T、B和NK细胞比例极低,对照鼠为同周龄CD®(SD)大鼠。
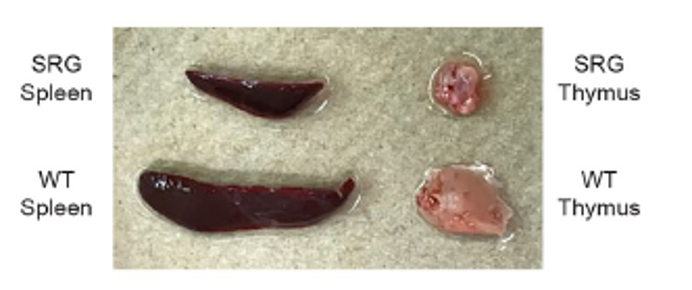
SRG大鼠的胸腺与脾脏严重萎缩[1]。
免疫缺陷小鼠体型小,在肿瘤免疫研究中存在肿瘤负荷量小、可获取的生物样本量有限、外科操作难度高等不足。大鼠的体型优势则可以很好地解决这些难题,但由于技术限制,转基因大鼠的进展较为缓慢,目前常用的免疫缺陷大鼠模型只有裸大鼠(RNU),用于肿瘤学和外科学研究。然而裸大鼠免疫缺陷程度较轻,仅存在T细胞缺陷,可成功移植的异种细胞系有限。
SRG大鼠同时具有体型和重度免疫缺陷的特点,填补现有大小鼠免疫缺陷模型的空白,在肿瘤学、免疫学、异种移植研究中展现独特优势:
1. 更多种类的人源CDX/PDX模型建立,快速扩充肿瘤生物样本库。
2. 体型大
3. 支持3R原则,减少动物用量
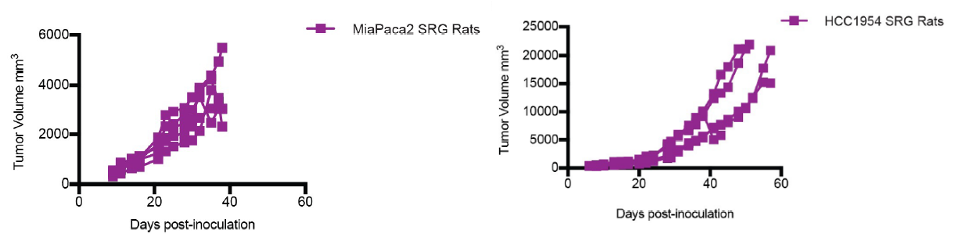
胰腺癌MiaPaca-2,乳腺导管癌HCC1954
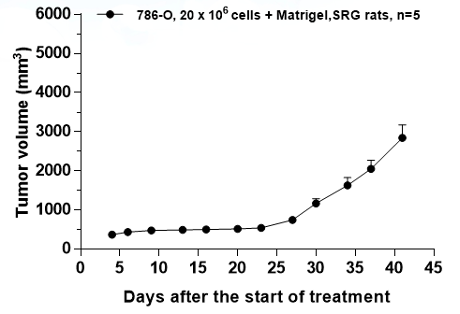
肾细胞腺癌786-o (维通利华客户合作数据)
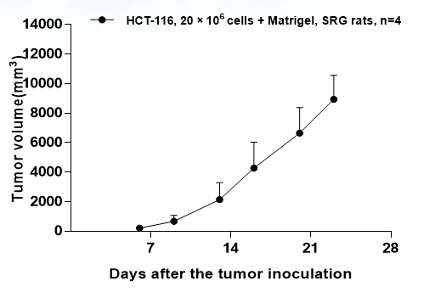
人结肠癌HCT-116(维通利华客户合作数据)
尤其是在免疫缺陷小鼠上移植成功率低且一致性差的细胞系,如人前列腺癌VCap [1],使用SRG大鼠不仅成功率高达80%,肿瘤生长迅速,大大节省入组前的时间成本。

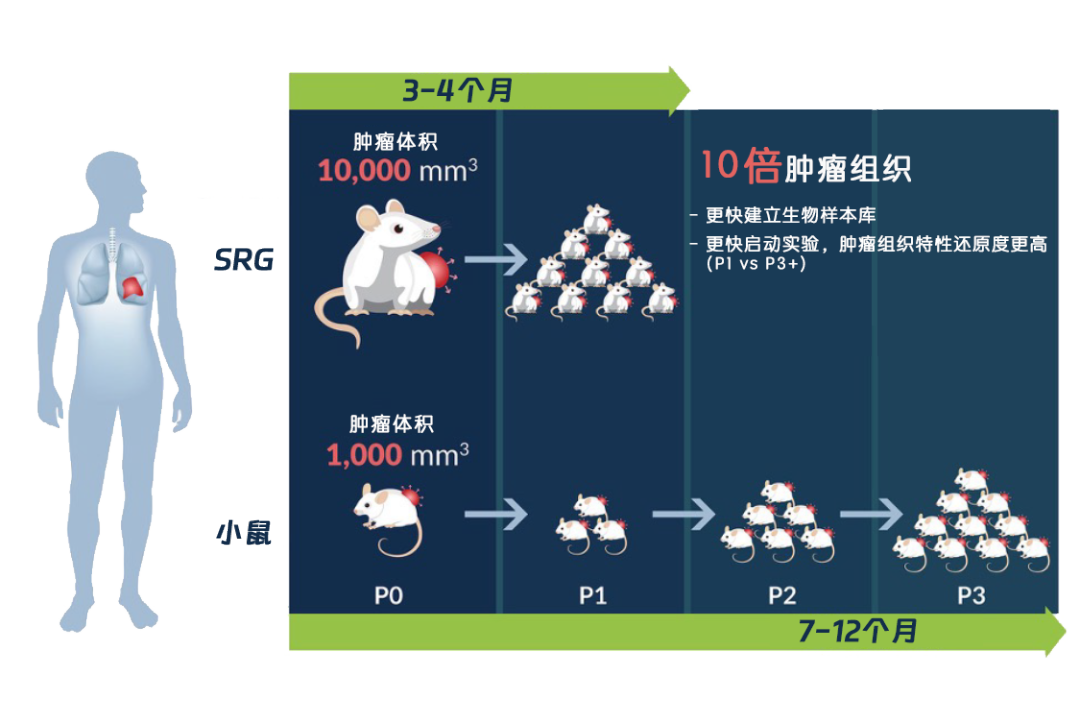
因患者组织来源珍贵且异质性高,使用免疫缺陷小鼠传代时常面临荷瘤失败率高、肿瘤增长慢,肿瘤组织获取量少等问题,需要很长时间才能获得足够数量肿瘤组织和动物模型。在SRG大鼠上建立PDX模型,成功率远高于免疫缺陷小鼠。如建立非小细胞肺癌(NSCLC)PDX模型,9名患者来源的肿瘤组织中有7块最终成功移植,移植成功率高达78%。且SRG大鼠体型大,耐受力强,可承担的肿瘤负荷是小鼠的10倍,通过少次传代即可迅速建立、扩大肿瘤样本库,尽快开展项目研究。组织学分析和NGS结果显示:使用SRG大鼠传代后的肿瘤组织学特点保持高度一致,且致病性SNP保留度高,避免了肿瘤细胞在传代过程中因基因漂变等变异。
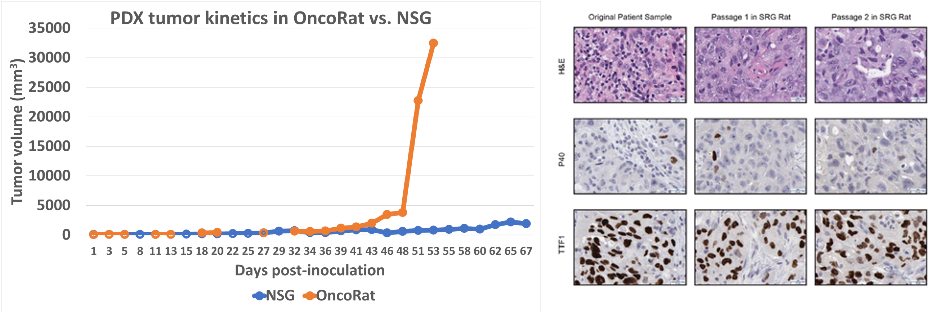
将同一患者来源的非小细胞肺癌(NSCLC)组织块分别移植到SRG大鼠(OncoRat)和NSG小鼠皮下。1)肿瘤动力学数据显示SRG大鼠支持肿瘤组织在体内更快增殖;2)不同代次间SRG大鼠体内肿瘤p40和甲状腺转录因子1(TTF1)表达量类似[1-2]。
在异种肿瘤移植模型上继续进行的药效、药代动力学和毒理学等评估中,SRG大鼠的体型优势被进一步放大:

有研究发现[3],同一种药物在大鼠与小鼠体内的生物利用度略有不同。尽管原因尚不清楚,这一发现可为临床前动物模型的选择提供更多思路。
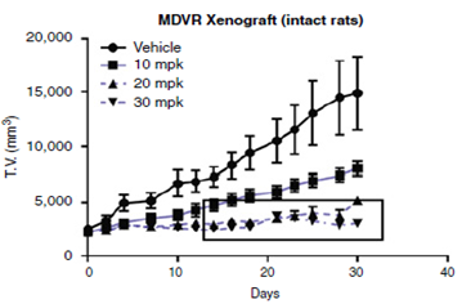
研究者发现,相较于小鼠,测试药物在大鼠体内的生物利用度高且更稳定,进而使用SRG大鼠荷瘤模型进行药效测试,发现药物对前列腺癌 (MDVR) 的抑制性呈剂量正相关性[3]
SRG大鼠支持人体器官/组织移植再生,再生组织可复现组织学特点与功能。
同时将人胎儿全层皮肤、胎儿自体肝脏来源脐带血干细胞(HSC)和自体胸腺组织移植到SRG大鼠,构建人源化模型(hSIS)。皮肤组织移植后可继续发育出多种皮肤细胞,如角质细胞、皮肤成纤维细胞、皮肤免疫细胞和免疫细胞和和Langerhans细胞,呈现成人皮肤组织学结构。还可模拟微生物感染实验,为进一步了解皮肤感染提供了研究平台。
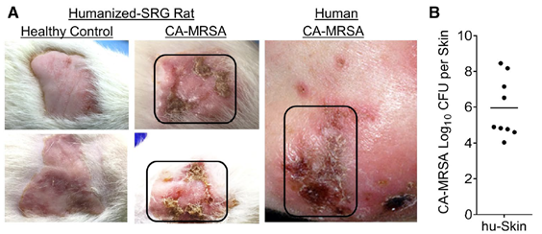
图:将耐甲氧西林的金黄色葡萄球菌(CA-MRSA)皮内注射到SRG大鼠体表移植的人类皮肤,建立皮肤感染模型。A)人源化SRG大鼠皮肤感染外观与患者感染外观比较;B)感染6周后,人源化SRG大鼠皮肤内CA-MRSA细菌载量高[4]。
SRG大鼠还支持人外周血单个核细胞(PBMCs)移植,重建以T细胞为主的人源化免疫系统[5]。
SRG大鼠表现为重度免疫缺陷(T、B、NK细胞缺失),可支持异种细胞/组织/器官移植。结合其体型大的特点,具有多重优势。尤其是在异种肿瘤移植、PK/PD实验中,弥补现有免疫缺陷大小鼠模型的不足,提高实验效率。
参考文献:
1. Noto, Fallon K et al. “The SRG rat, a Sprague-Dawley Rag2/Il2rg double-knockout validated for human tumor oncology studies.” PloS one vol. 15,10 e0240169. 7 Oct. 2020, doi:10.1371/journal.pone.0240169
2. . Bisoye, Towobola et al. “The SRG OncoRat®; A Rag2/Il-2rg double-knockout rat supports enhanced precision-medicine based cancer studies. ”AACR-NCI-EORTC 2019 Internation Conference on Molecular Targets & Cancer Therapeutics, Oct. 2019, doi: 10.13140/RG.2.2.11208.88323.
3. Ponnusamy, Suriyan et al. “Orally Bioavailable Androgen Receptor Degrader, Potential Next-Generation Therapeutic for Enzalutamide-Resistant Prostate Cancer.” Clinical cancer research : an official journal of the American Association for Cancer Research vol. 25,22 (2019): 6764-6780. doi:10.1158/1078-0432.CCR-19-1458
4. Agarwal, Yash et al. “Development of humanized mouse and rat models with full-thickness human skin and autologous immune cells.” Scientific reports vol. 10,1 14598. 3 Sep. 2020, doi:10.1038/s41598-020-71548-z
5. Noto, Fallon K et al.“The SRG™ rat: A novel SCID rat for humanization studies.” https://www.herabiolabs.com/wp-content/uploads/2018/01/Hera-AACR18-Poster-The-SRG-rat-a-novel-SCID-rat-for-humanization-studies.pdf#:~:text=The%20SRG%20rat%20is%20also%20permissive%20to%20immune,show%20significant%20levels%20of%20circulating%20human%20B%20cells.




