作者:宫世玲,Charles River 维通利华 高级产品经理, Shiling.Gong@criver.cn
随着药物研发的工作重点迅速转向更复杂和更具特异性的生物疗法,寻找适合临床前研究的体内模型变得越来越困难。越来越多的研究人员希望通过人类免疫系统(HIS)重建模型,以帮助解决现阶段药物体内研究的挑战。
免疫系统重建模型解决了临床前研发中“人类特异性”的问题,这是其他模型无法做到的。它们可被诱导为人类疾病模型(如癌症模型、传染病模型,自免模型等),同时也可促进各种人类细胞和人体组织的移植,这将包含大量的人类分子可供潜在的药物靶点筛选。一个合适的HIS模型可以节省宝贵的时间和有限的资源,因为它允许药物研发可在没有基因工程替代模型和替代试验品的情况下进行,即使有替代模型,选择合适HIS的模型,仍旧是助力药物研发的有利武器。
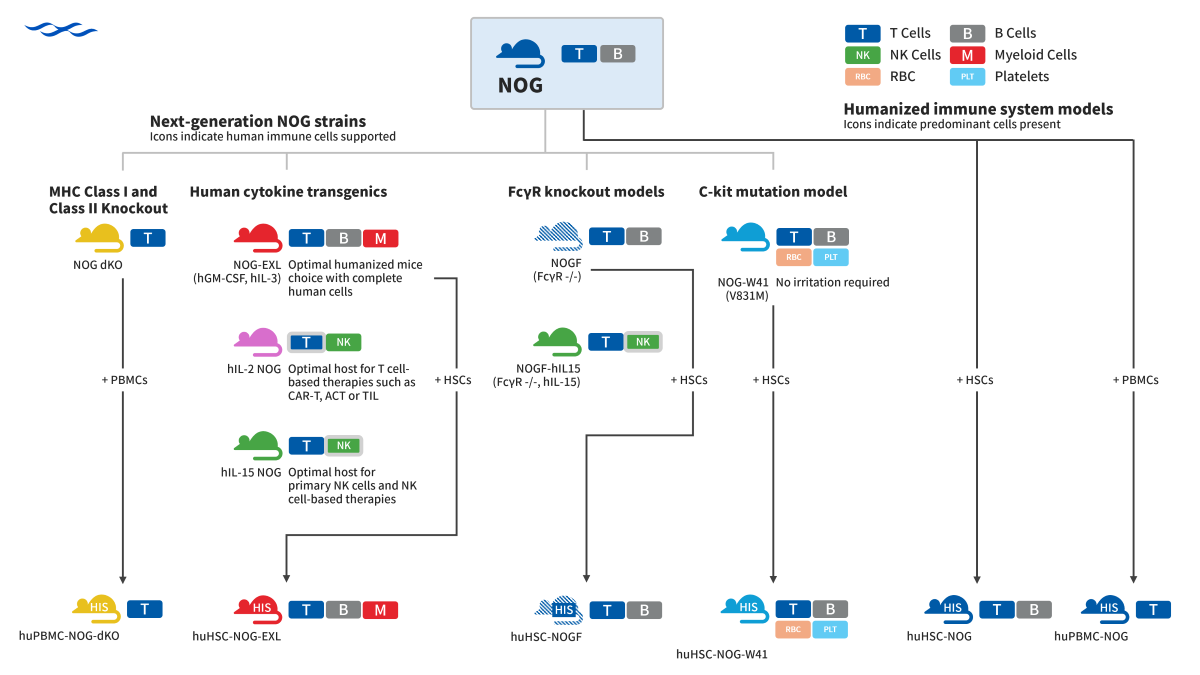
2002年,全球首款超重度免疫缺陷小鼠——NOG小鼠问世。它显著提升了人源细胞/组织的移植效率,同时是第一个克服了制约人源免疫系统重建因素的模型,为肿瘤免疫药物的研发和突破提供了极具价值的模型平台。随着药物研发的不断深入,一系列NOG衍生品系诞生,解决了临床前药物研发不同方向的研发困境。这些模型或者进一步缩小小鼠与人类的生物学差异,或者更好地重建人的免疫系统,更好地支持某些肿瘤类型的移植,或者延长研究窗口期,或者提高药物研发的准确性……
本文将从小鼠品系命名的角度,为大家快速解读不同NOG衍生品系对研发者带来的意义,这将有助于研发者快速定位适合自己研发的模型。
文末附赠:NOG家族品系图谱!
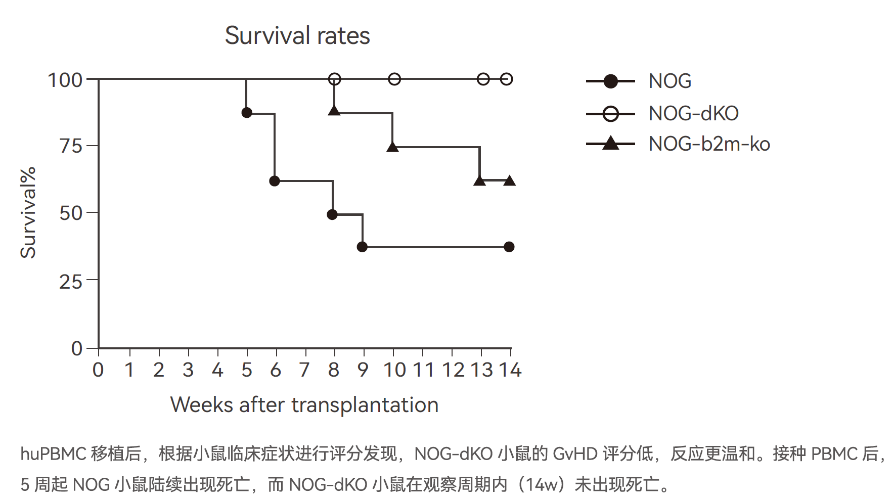
NOG-dKO是指在NOG小鼠的基础上敲除了鼠源的B2m基因和Ab1基因(Double Knock Out),使得小鼠的MHC I类分子和MHC II类分子表达缺失,因而简称为NOG-dKO小鼠。
在日本CIEM(原日本CIEA),这个模型更名为NOG-ΔMHC;因为在生物学中,希腊字母Δ表示“基因缺失”或“功能缺陷”。
NOG小鼠移植人源PBMC,能够很好地实现人源T细胞的扩增;但同时T细胞也会识别小鼠组织器官表面的MHC分子进行免疫攻击,造成GVHD(Graft Versus Host Disease),使得研究窗口期受限,一般建议在4-5周内完成实验。
使用NOG-dKO小鼠,PBMC移植或者T细胞治疗药物移植后将无法识别小鼠表面的MHCⅠ/Ⅱ分子,不能进行免疫攻击,窗口期可延长至8-12周。
使用NOG-dKO小鼠进行PBMC移植,不会引起由于Xeno-GvHD诱导的非特异性T细胞扩增,更利于抗肿瘤药效评估的准确性。
NOG-dKO小鼠特别适用于CAR-T等T细胞治疗药物的临床前药效评估。
NOG-EXL是指在NOG小鼠的基础上转入了人的细胞因子IL-3和GM-CSF, 可以更好地促进HSC造血干细胞的分化及髓系细胞的发育。取名NOG-EXL, 取自Excellent Lineage更优模型的前缀缩写。
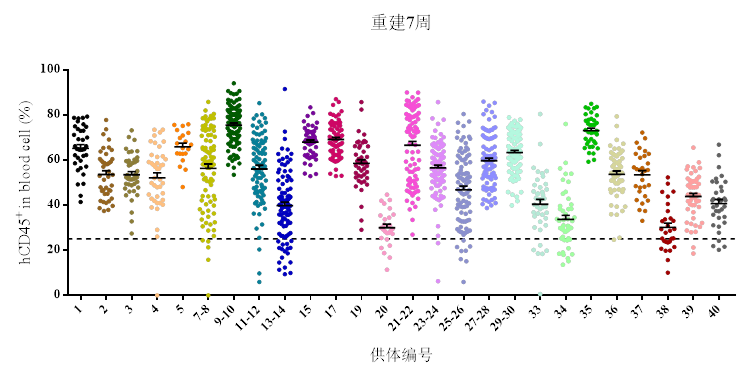
NOG小鼠辐照后,移植人的造血干细胞HSC能够实现人源免疫细胞的分化及重建,但重建出来的主要是人的T/B细胞,无髓系细胞的分化,且重建效率偏低。
使用NOG-EXL小鼠,将促进HSC移植后多种免疫细胞的分化,除了人源T/B细胞外,还有多种髓系细胞的分化,包括单核细胞、巨噬细胞、粒细胞和树突状细胞等。
hIL-15 NOG是指在NOG小鼠的基础上转入了人的细胞因子IL-15, 故称之为hIL-15 NOG。
缺少人源细胞因子IL-15的刺激下,人源NK细胞很难在小鼠体内扩增。
使用hIL-15 NOG小鼠,可以实现人源NK细胞在小鼠体内增殖,进一步发挥NK细胞的杀伤活性。

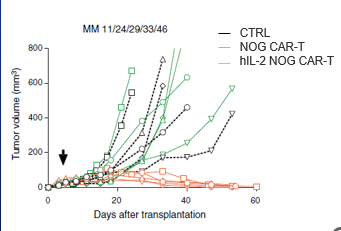
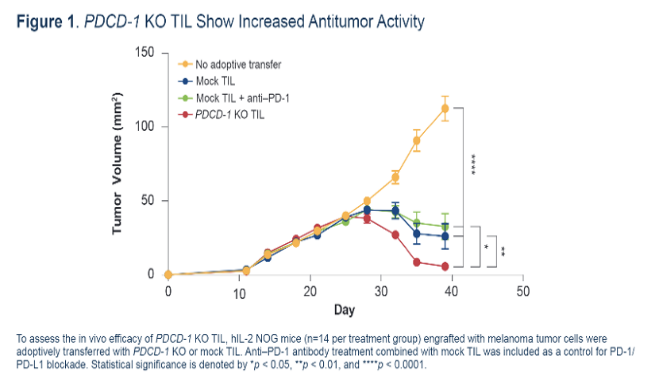
hIL-2 NOG是指在NOG小鼠的基础上转入了人的细胞因子IL-2, 故称之为hIL-2 NOG。
由于实体瘤免疫微环境的复杂性,T细胞治疗部分实体瘤时,临床前不能很好地浸润到肿瘤内部发挥抗肿瘤活性,不能很好地重复临床上的药效。
使用hIL-2 NOG小鼠进行T细胞治疗药物的实体瘤研究时,人源IL-2细胞因子可以很好地促进T细胞浸润到实体瘤内部发挥抗肿瘤活性。
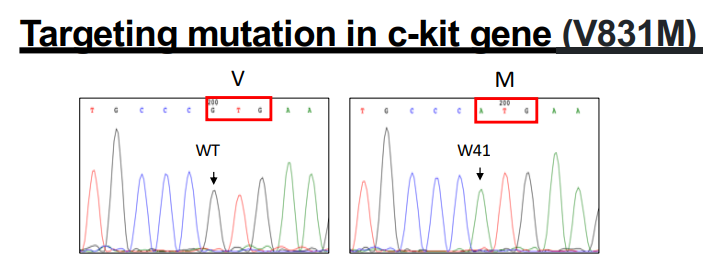
NOG-W41是指在NOG小鼠的基础上将c-kit基因2519核苷酸位点发生G to A的突变,导致831位氨基酸位点由Val(缬氨酸)变为Met(蛋氨酸)。c-kit基因位于小鼠的小鼠 W基因座,其中W突变即是c-kit基因的突变形式。W突变有多种,包括致死性突变W37、中度性突变W41/W55、及轻度突变W44/W57。其中W41突变即是上述c-kit 蛋白的第831 位Val 至Met 的点突变, 该中度突变使得小鼠出现小鼠自身造血干细胞功能受到抑制且出现贫血,但动物能够正常健康存活。故小鼠的命名为NOG-W41。
NOG-W41小鼠由于c-kit突变使得小鼠本身造血干细胞功能受到抑制,故在进行HSC造血干细胞移植时,无需进行辐照即可以重建成功。
NOGF是指在NOG小鼠基础上将小鼠的FcgR 受体敲除获得的模型,称之为NOG-FcgR KO小鼠,简称NOGF。
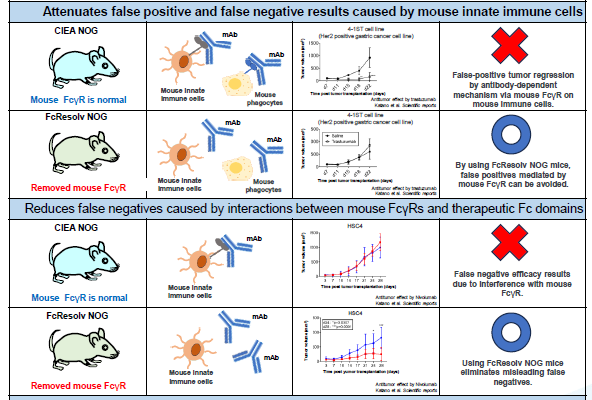
抗体类药物临床前药效评估中,鼠源髓系细胞表面FcγR与药物Fc端结合会触发巨噬细胞ADCP效应。若抗体靶向人源T细胞(如PD-1抗体),可能导致鼠巨噬细胞吞噬T细胞,造成发挥抗肿瘤活性的T细胞减少,产生假阴性结果。
使用FcgR 受体敲除的NOGF小鼠,进行抗体药物评估时,可以消除鼠源巨噬细胞ADCP干扰,提高抗体药物评估的准确性。
NOGF-hIL15是指将NOGF回交到hIL-15 NOG中,获得的新品系,其缺乏鼠源FcγRs,同时表达人源的IL-15细胞因子,称为NOGF-hIL15。
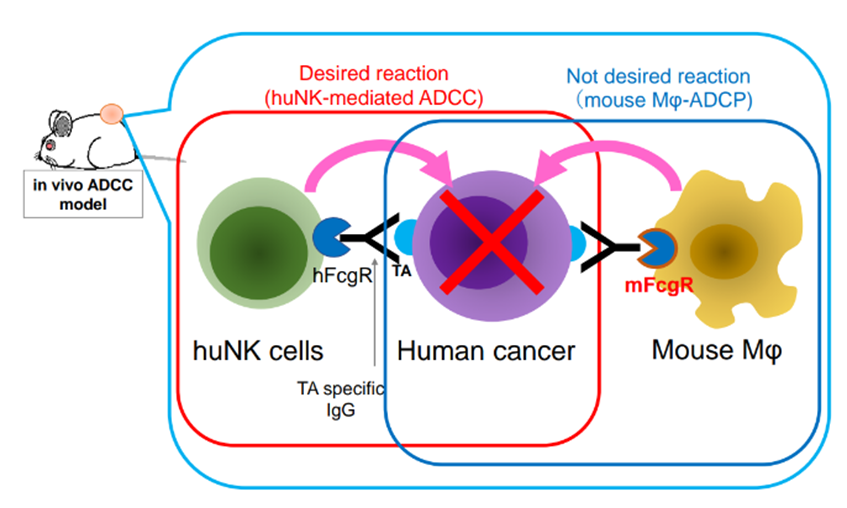
靶向NK细胞的ADCC抗体药物药效评估时,鼠源髓系细胞表面FcγR与药物Fc端结合会触发巨噬细胞ADCP效应,由于抗体的Fab端靶向人的肿瘤,会导致鼠源巨噬细胞吞噬肿瘤,而非基于人的NK细胞产生的ADCC效应,故产生假阳性结果。
使用NOGF-hIL15小鼠,即可以很好地实现人源NK细胞的扩增(表达人源细胞因子IL-15),又缺乏了鼠源FcγRs,消除鼠源巨噬细胞引发的ADCP效应,提高ADCC抗体药物评估的准确性。
适用于hIL-15 NOG小鼠的所有应用领域; 且对抗体类药物而言,可消除鼠源免疫细胞ADCP效应干扰。
NOG及系列衍生鼠模型在难移植细胞系建模,PDX模型构建及人源化模型构建有显著优势,希望通过本文的介绍,能让研发者在免疫系统重建动物的选择有更清晰的认识,更好地助力于肿瘤药物的开发。
欢迎与产品经理深入交流,并可获取NOG系列衍生家族图谱的高清图。
获取更多NOG衍生品系模型技术指标,可咨询维通利华产品经理:
产品咨询:Product@criver.cn
订购电话:010-84744555
订购邮箱:Order@criver.cn




